动脉粥样硬化引起的心血管疾病是全球范围内的主要死亡原因之一。越来越多的证据表明,巨噬细胞具有“免疫记忆”特性,在受到内源性致粥样硬化因子(如氧化脂质、胆固醇晶体和炎症介质)的训练后,会表现出更强的炎症活性,从而促进疾病发展。
现有研究提示,组蛋白修饰引起的表观遗传重编程可能是训练有素的先天免疫细胞增强功能状态的核心机制。目前基于巨噬细胞表型重编程的动脉粥样硬化治疗效率低下的原因可能是持续的过度炎症训练导致巨噬细胞的表观遗传沉默。
2025年10月14日,刘肖珩教授团队在Nature Communications发表了题为“Reprogramming mitochondrial metabolism and epigenetics of macrophages via miR-10a liposomes for atherosclerosis therapy”的研究论文。报道了一种负载流体剪切力响应性miR-10a的仿生脂质体(miR-10a@H-MNP),可以靶向斑块炎性巨噬细胞,通过恢复线粒体代谢功能和重塑表观遗传状态来重编程斑块内巨噬细胞为抗炎表型。该研究提出了一种通过精确调节线粒体代谢来阻止动脉粥样硬化进展的治疗策略,具有巨大的临床应用潜力。

作者通过分析人冠状动脉斑块scRNA测序数据鉴定出6个CD45+簇。进一步研究发现,斑块中M1表型巨噬细胞的数量高于M2表型的数量。此外,M1表型巨噬细胞中组蛋白去乙酰化酶HDAC1、HDAC2和HDAC3的基因表达水平显著更高。临床病理样本检测也证实斑块内炎性巨噬细胞组蛋白乙酰化水平(H3K9Ac) 较低,且线粒体氧化磷酸化代谢相关功能受损。
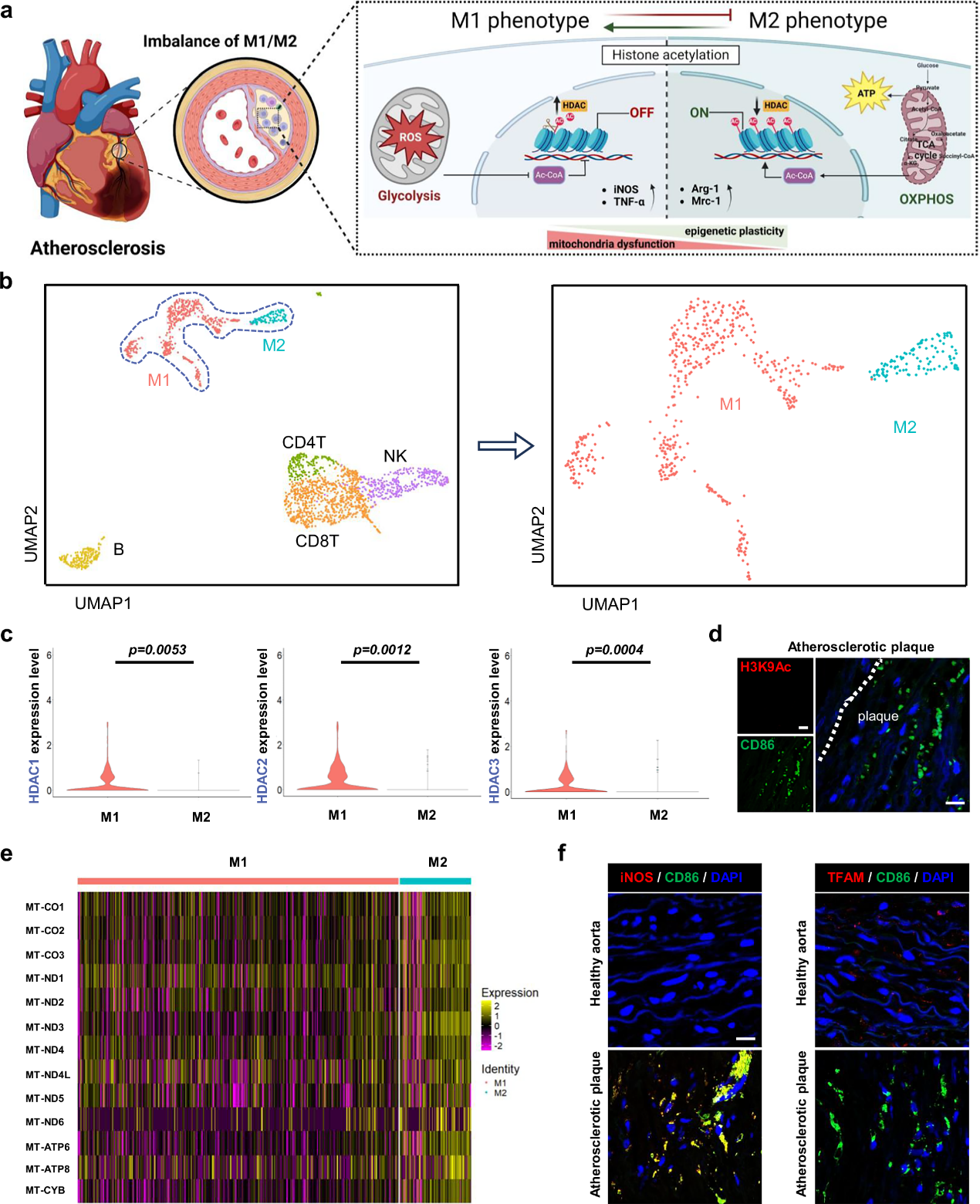 图1动脉粥样硬化斑块中M1表型巨噬细胞的表观遗传沉默和线粒体功能障碍
图1动脉粥样硬化斑块中M1表型巨噬细胞的表观遗传沉默和线粒体功能障碍
随后,作者分析了炎性巨噬细胞中差异表达miRNA,发现miR-10a-5p在M1表型巨噬细胞中显著下调,且与巨噬细胞线粒体代谢重塑有关。体外研究发现,miR-10a可以恢复M1表型巨噬细胞线粒体能量代谢,并显著增加组蛋白乙酰化水平(H3K9Ac)从而重编程M1表型巨噬细胞为M2表型。
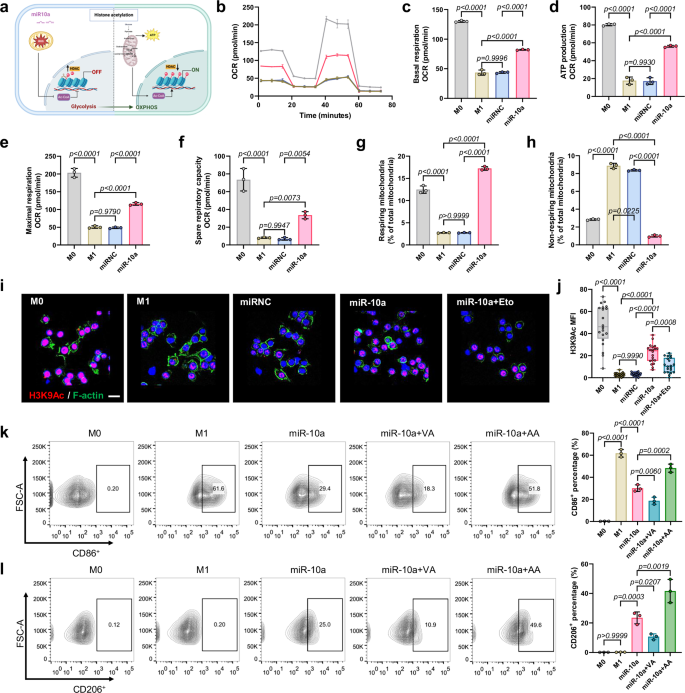 图2 miR-10a通过挽救线粒体功能和重塑表观遗传来复极化巨噬细胞表型
图2 miR-10a通过挽救线粒体功能和重塑表观遗传来复极化巨噬细胞表型
为了克服miR-10a的脱靶效应,提高治疗效果,作者设计并制造了一种用于抗动脉粥样硬化治疗的多功能miR-10a@H-MNP仿生纳米系统。首先,将负载miR-10a的ROS响应性脂质体与红细胞膜融合,再通过点击化学接枝HA-PEG-MAL至表面。体外结果证实,miR-10a@H-MNP可被炎性巨噬细胞内吞且呈时间依赖性趋势;体内结果证实,miR-10a@H-MNP可以靶向斑块中的炎性巨噬细胞。
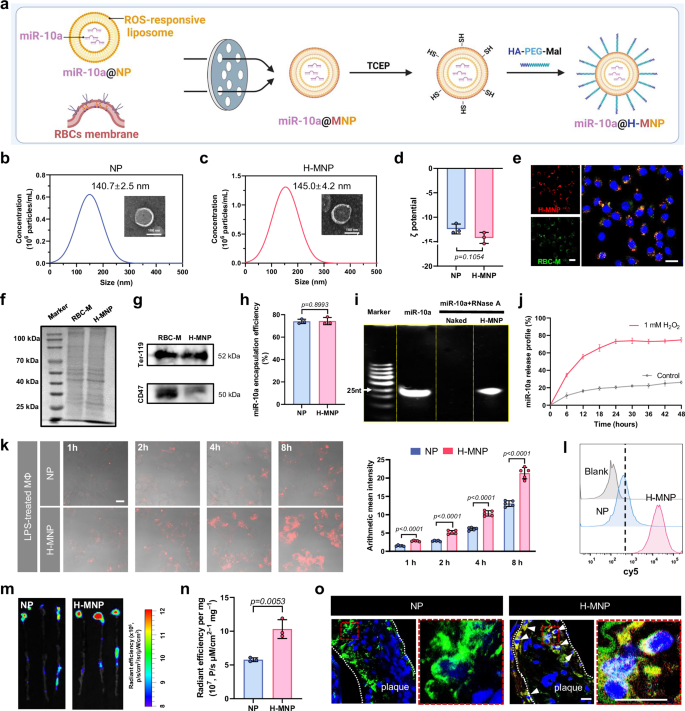 图3 miR-10a@H-MNP的制备、表征和靶向能力评估
图3 miR-10a@H-MNP的制备、表征和靶向能力评估
作者进一步评估了miR-10a@H-MNP在体内的治疗效果。结果发现,miR-10a@H-MNP治疗可以显著减少主动脉斑块脂质沉积,减少主动脉根部脂质含量和坏死核心面积,增加胶原含量并提高斑块稳定性。
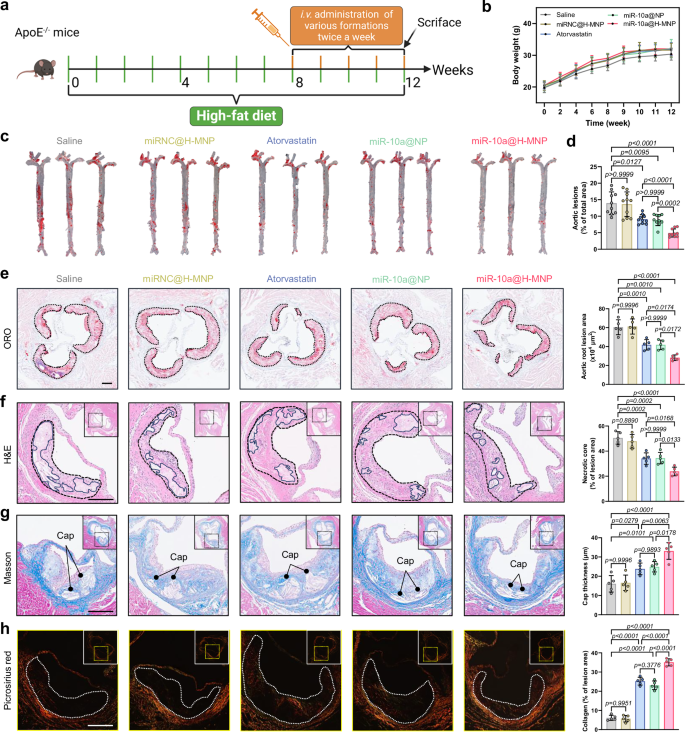 图4 miR-10a@H-MNP在体内的治疗效果
图4 miR-10a@H-MNP在体内的治疗效果
最后,作者在体内评估了miR-10a@H-MNP对斑块巨噬细胞的影响。结果发现,miR-10a@H-MNP治疗可以显著降低主动脉根部中的中性脂滴含量和ROS水平,显著减少M1表型巨噬细胞数量并增加M2表型巨噬细胞数量;在体内恢复巨噬细胞线粒体能量代谢并重塑其表观遗传特性。
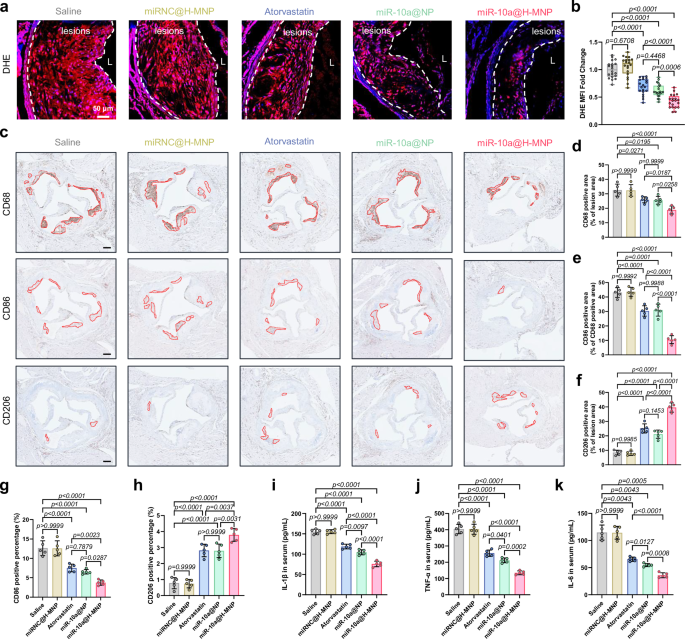 图5 miR-10a@H-MNP在体内重编程巨噬细胞表型
图5 miR-10a@H-MNP在体内重编程巨噬细胞表型
该研究发现,miR-10a@H-MNP可以通过调节巨噬细胞线粒体代谢和表观遗传状态,有效地重新编程巨噬细胞表型。通过解决靶向递送和微环境响应药物释放的双重挑战,该策略不仅减轻了动脉粥样硬化,还为治疗其他免疫记忆驱动的慢性炎症性疾病提供新思路。
华西基础医学与法医学院房飞副研究员(专职科研)为论文第一作者;刘肖珩教授为论文通讯作者。该工作受到国家自然科学基金(12372315、32301089)资助。
参考文献:
Fang, F., Wang, E., Yang, H. et al. Reprogramming mitochondrial metabolism and epigenetics of macrophages via miR-10a liposomes for atherosclerosis therapy. Nat Commun 16, 9117 (2025).https://doi.org/10.1038/s41467-025-64201-8