近日,我院刘肖珩课题组在 Genes & Diseases、Theranostics 杂志上连续发表研究性论文,通过探索动脉粥样硬化发生的力学生物学机制,提出一种基于力学敏感蛋白CTSK的靶向响应性纳米粒的新型治疗策略。
动脉粥样硬化(AS)是一种慢性炎症性疾病,好发于血管分叉和弯曲部位,表现为血流动力学异常变化,如发生扰动流(disturbed flow)和流动分离(flowseparation)等。前期研究证实,动脉粥样硬化部位扰动流可上调多种蛋白酶的表达,进而降解弹性纤维和胶原等细胞外基质成分,导致血管内皮功能障碍和血管重构。课题组首先明确组织蛋白酶K(CTSK)作为降解细胞外基质蛋白的重要媒介,是否响应扰动流的调控,并促进动脉粥样硬化的发生,进而解析扰动流调控CTSK表达并介导动脉粥样硬化发生的力学生物学机制。在此基础上,设计了一种CTSK酶响应性的靶向纳米递送系统用于动脉粥样硬化治疗。
通过研究发现,扰动流可通过Integrin-细胞骨架-NF-ĸB信号轴介导血管内皮炎症,进而影响动脉粥样硬化发展进程。相关结果发表于Genes & Diseases 杂志(Cathepsin K contributed to disturbed flow-induced atherosclerosis is dependent on Integrin-actin cytoskeleton-NF-κB pathway, 2022年4月25日)。
课题组通过小鼠左颈总局部结扎的方法构建在体扰动流模型。结果证实,体内扰动流可加速ApoE-/-小鼠动脉粥样硬化斑块形成,小鼠左颈总血管直径增大、内膜厚度增加以及弹性蛋白层破裂(图1)。

图1 体内扰动流引起动脉粥样硬化发生及血管重构
en face 免疫荧光染色结果显示,C57BL/6小鼠扰动流区(LCA, AA)血管内皮细胞中CTSK的表达明显高于层流区(RCA, DA)(图2A)。此外,与层流剪切力区域(RCA, DA)相比,体内扰动流区域(LCA, AA)的CTSK蛋白和mRNA水平显著上调(图2B&C)。

图2 体内扰动流引起CTSK高表达
通过体内阻断力学感受器Integrin发现,扰动流引起的动脉粥样硬化发生减轻;而阻断Integrin可减少扰动流引起的CTSK表达,并显著抑制扰动流引起的血管重构(图3)。
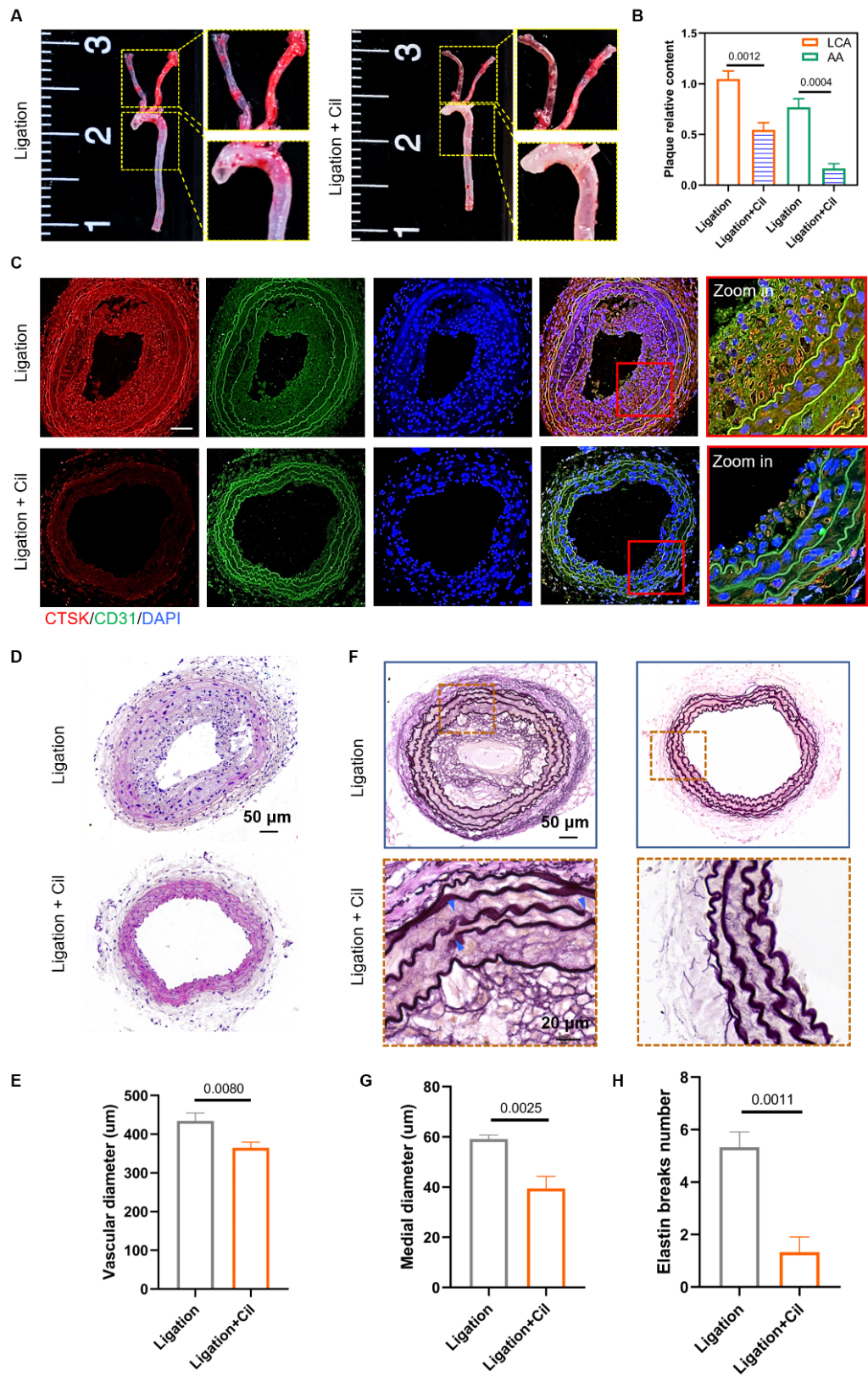
图3 阻断Integrin抑制扰动流引起的动脉粥样硬化及血管重构
在此基础上,课题组构建了基于力学敏感蛋白CTSK的靶向响应性纳米粒用以动脉粥样硬化的治疗。相关结果发表于Theranostics 杂志(Inflammatory endothelium-targeted and cathepsin responsive nanoparticles are effective against atherosclerosis, 2022年5月16日)。

课题组设计合成了动脉粥样硬化靶向和CTSK酶敏感的嵌段聚合物 PLGA-PEG-c(RGDfC)和 PLGA-Pep-PEG,并将两种聚合物与免疫抑制剂雷帕霉素(RAP)结合,制备出兼具靶向和响应功能的载药纳米粒RAP@T/R NPs。表征结果显示(图4),T/R NPs呈均匀球形,粒径约为274 nm,且具有较好的体外稳定性。RAP@T/R NPs可在CTSK酶的作用下快速释放药物。

图4 靶向响应性纳米粒治疗动脉粥样硬化示意图及体外表征
体外治疗效果显示,RAP@T/R NPs可以抑制炎性巨噬细胞吞噬氧化低密度脂蛋白,抑制炎性因子TNF-α、IL-1β和MCP-1的释放,并抑制巨噬细胞增殖(图5)。
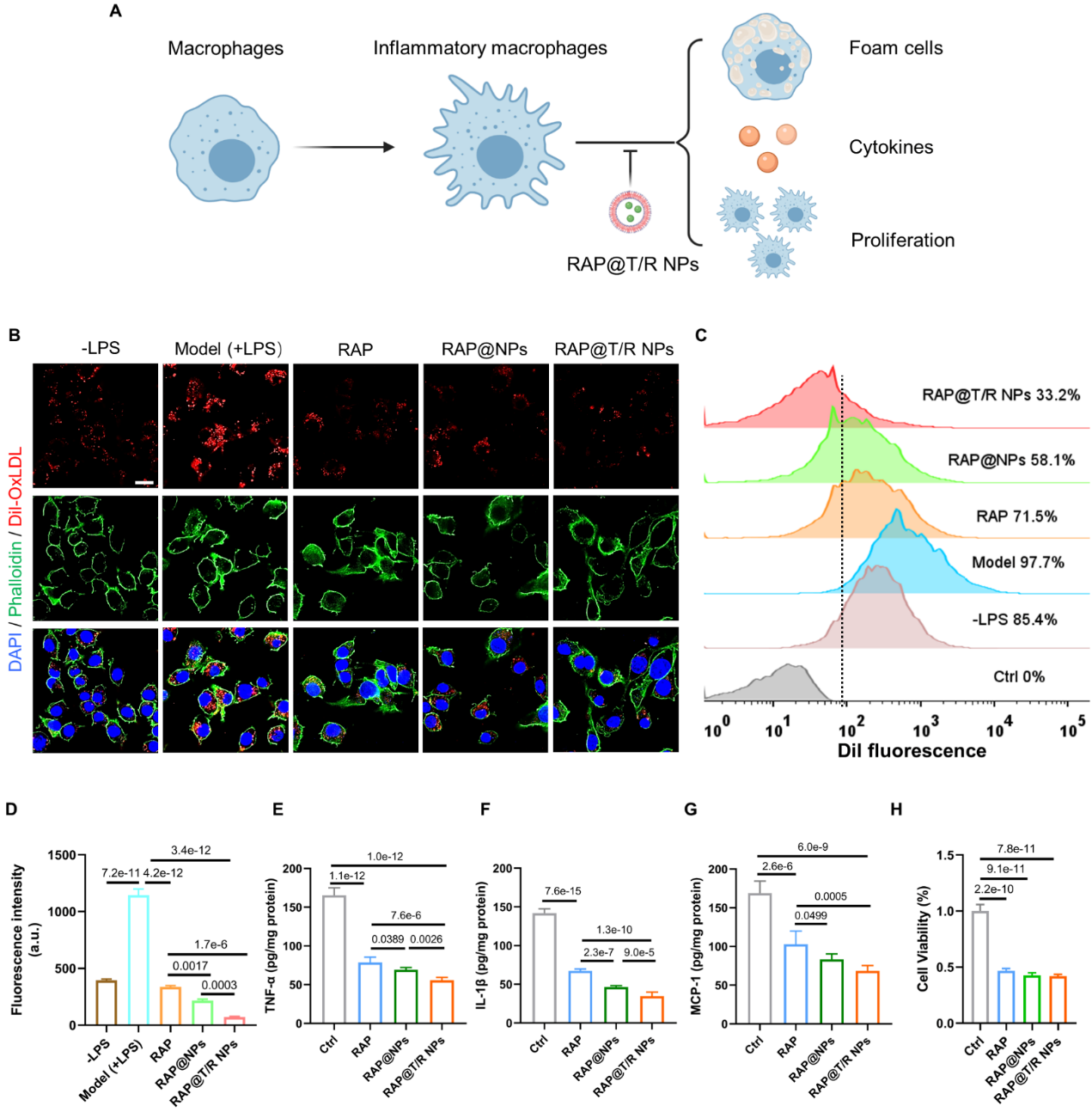
图5 RAP@T/R NPs体外治疗效果评价
动物体内治疗结果显示,RAP@T/R NPs与对照组相比可以显著减少脂质在主动脉沉积,显著抑制动脉粥样硬化进展(图6)。这项研究成果有望为临床上动脉粥样硬化靶向给药治疗提供新的思路。

图 6RAP@T/R NPs体内治疗效果
我院刘肖珩教授和沈阳教授为两篇论文的共同通讯作者,美国加州大学洛杉矶分校Song Li教授为 Theranostics 论文共同通讯作者,我院2018级博士生房飞为两篇论文第一作者。该研究得到国家自然科学基金重点项目(11932014)和面上项目(32071312)的支持。
原文链接:https://www.thno.org/v12p4200.htm;
https://doi.org/10.1016/j.gendis.2022.03.020.