心血管疾病(Cardiovascular disease,CVD)是全球范围内最主要的死因,动脉粥样硬化(atherosclerosis, AS)是众多心脑血管疾病发生的共同病理基础,流体剪切力(fluid shear stress, FSS)是调控AS发生的重要因素。作为血液和血管组织间屏障的血管内皮细胞(Vascular endothelial cells, VECs)在AS发生发展过程中起着关键作用,其响应FSS刺激的方式和机制是当前研究的热点。
近日,四川大学华西基础医学与法医学院刘肖珩教授团队联合美国哈佛大学Lance L. Munn教授在国际著名心血管期刊Cardiovascular Research发表题为“Endothelial mechanobiology in atherosclerosis”的长文综述。全面阐释了FSS如何参与调节VECs功能改变进而促进动脉粥样硬化发展。概括了病理条件下的内皮细胞力学生物学,体内/外模拟FSS的方法,内皮细胞力学感受器和FSS对血管内皮细胞功能的调控,以及内皮力学转导的潜在机制。在此基础上,进一步分析了这些信号通路被应用于临床工作的可能性,并对靶向力学转导的动脉粥样硬化治疗方法进行了总结。

文章指出,动脉粥样硬化被认为是各种因素共同作用导致,但其特殊的力学微环境是影响动脉粥样硬化发生和发展的主要原因。由于位于血管内膜的内皮细胞直接感受力学刺激,因此,内皮功能失调是导致动脉粥样硬化发生发展的关键机制。
通过比较模拟生理/病理条件下力学微环境的体外/体内模型,归纳了各模型的优缺点。在此基础上,分析了VECs响应生理层流和病理扰动流的分子基础,总结了目前发现的内皮力学感受器,以及这些力学敏感元件如何感知力学信号并将其转化为生物信号,进而调控内皮细胞功能的力学生物学机制(图1)。作者强调,VECs响应FSS是一个复杂的过程,并且在力学转导过程中不同的力学感受器之间是相互关联的。同时指出,虽然目前研究已经揭示了一个复杂的信号网络,血流动力学通过该信号网络影响VECs功能和动脉粥样硬化。但是,当前面临的挑战是如何阐明这些力学转导机制如何协同工作,从而找到能够有效缓解或逆转动脉粥样硬化的关键靶点。最后,总结了与内皮力学转导相关的抗动脉粥样硬化药物,并讨论分析了靶向内皮力学转导的动脉粥样硬化治疗方法在临床中应用的可能性。
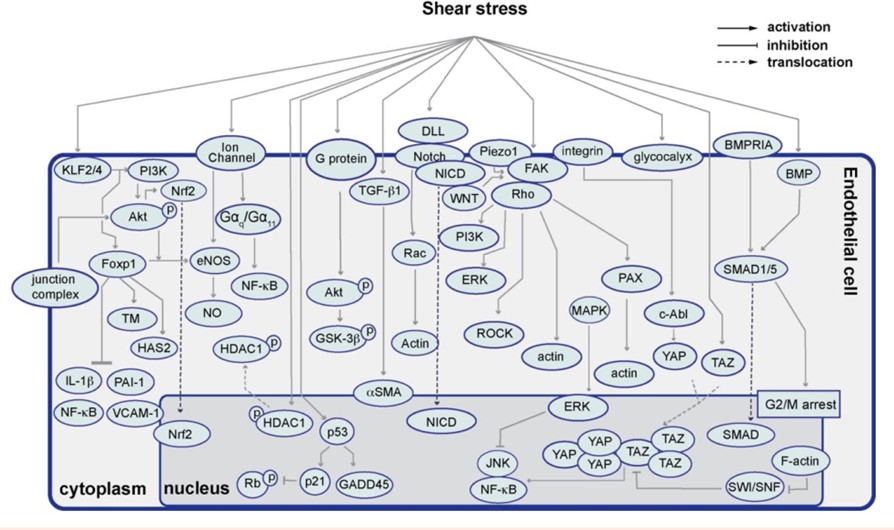 图1流体剪切力调控内皮细胞功能的可能机制
图1流体剪切力调控内皮细胞功能的可能机制
四川大学基础医学与法医学院2019级博士生汪小力为本文第一作者,刘肖珩教授和美国哈佛医学院Lance L. Munn教授为本文共同通讯作者。该文得到国家自然科学基金重点项目(11932014)和面上项目(1971239, 32071312和31870939)的支持。
原文链接:https://doi.org/10.1093/cvr/cvad076.