血流动力学在动脉粥样硬化性心血管疾病的发展过程中起重要作用。在动脉粥样硬化的好发区,血液流动表现为湍流和低剪切力;而健康血管部位的血流通常为高剪切层流。作为分隔血液和血管组织的屏障,血管内皮细胞直接暴露于血流环境中,可感受不同的流动形式而做出不同的响应。因此认为,血管内皮细胞响应层流剪切力(Laminarshear stress, LSS)所释放的细胞外囊泡(Extracellular vesicles, EVs)在维持血管稳态中起着关键的作用。同时,这种EVs有望成为治疗动脉粥样硬化的活性载体。
近日,我院刘肖珩团队在Biomaterials杂志发表了题为“Engineering extracellular vesicles derived from endothelial cells sheared by laminar flow for anti-atherosclerotic therapy through reprogramming macrophage”的研究论文。阐明了生理保护性层流剪切力刺激血管内皮细胞后所分泌的EVs对巨噬细胞表型转化的调控作用和分子机制,并探索了其在体内治疗动脉粥样硬化的潜力。我院2023级博士生李春丽和房飞助理研究员为论文第一作者,刘肖珩教授为通讯作者。

首先,作者通过平行平板流动腔对血管内皮细胞施加15 dyn/cm2的流体剪切力,通过超速离心法收集LSS刺激内皮细胞后分泌的EVs(LSS-EVs),并对其进行了形貌、粒径等表征。将LSS-EVs与M1型巨噬细胞共孵育后发现,LSS-EVs可以驱动促炎M1型巨噬细胞转化为抗炎的M2表型。
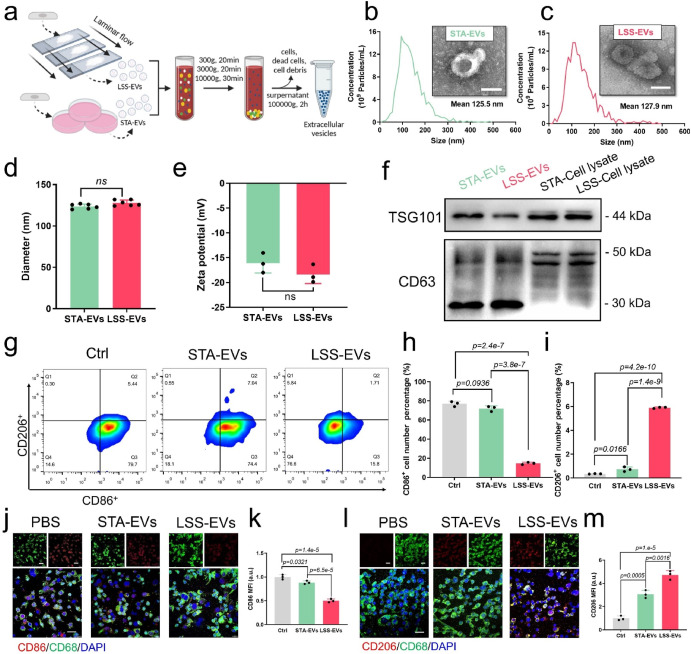 图1. LSS-EVs体外诱导M1型巨噬细胞表型转化
图1. LSS-EVs体外诱导M1型巨噬细胞表型转化
然后,作者通过对LSS-EVs的内容物miRNA测序并验证发现,LSS刺激ECs分泌的EVs与静态培养的ECs分泌的EVs相比具有显著差异。miR-34c-5p在LSS-EVs中高度富集,并证实miR-34c-5p是调控M1型巨噬细胞表型转化的关键分子。此外,机制研究进一步证实,miR-34c-5p通过靶向TGIF2并激活TGF-β-Smad3信号通路诱导巨噬细胞表型转化。
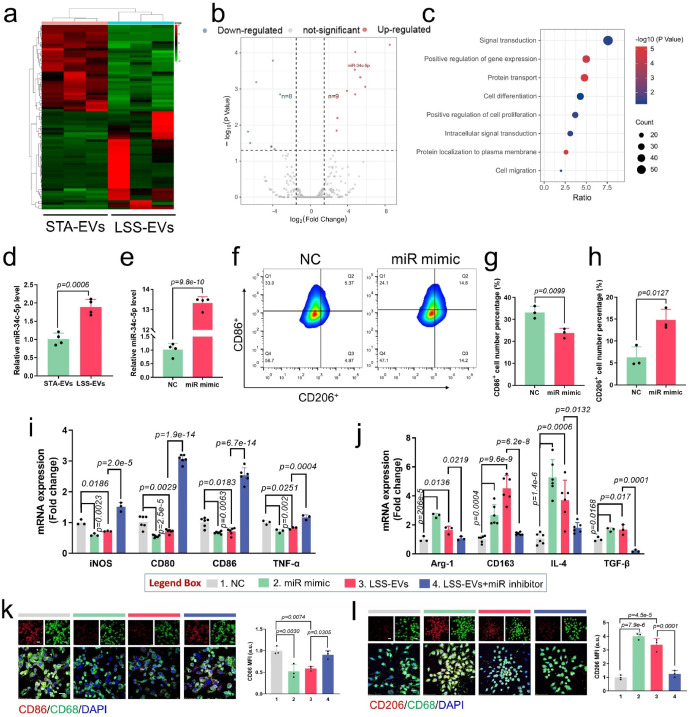 图2. LSS-EVs 在体外通过miR-34c-5p诱导M1型巨噬细胞表型转化
图2. LSS-EVs 在体外通过miR-34c-5p诱导M1型巨噬细胞表型转化
最后,作者通过点击化学方式在LSS-EVs表面修饰M1型巨噬细胞靶向分子HA(HA@LSS-EVs),并探索其在体内治疗动脉粥样硬化的潜力。体外实验表明,HA@LSS-EVs可更多的被M1型巨噬细胞内吞。体内实验进一步证实,HA@LSS-EVs可以有效靶向斑块的巨噬细胞,并显著抑制动脉粥样硬化进展。
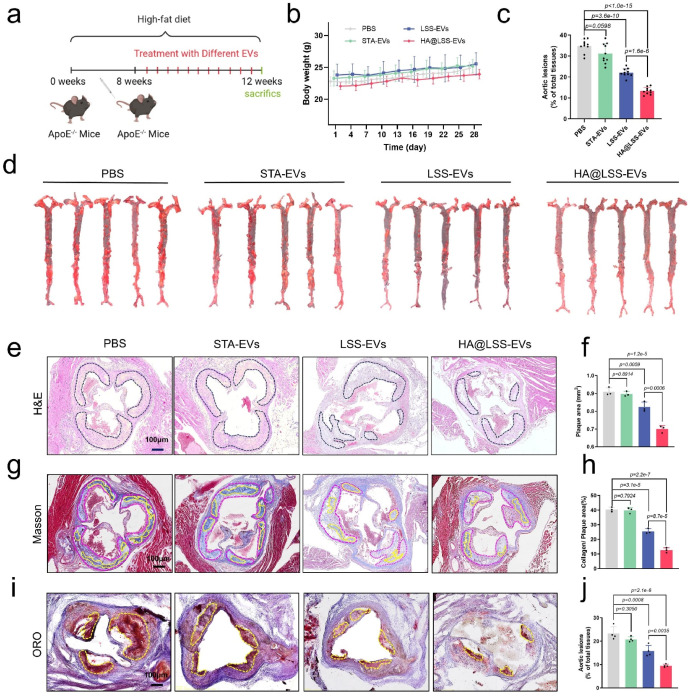 图3. HA@LSS-EVs在体内抑制动脉粥样硬化进展
图3. HA@LSS-EVs在体内抑制动脉粥样硬化进展
综上所述,在该研究中,作者巧妙地利用生物物理因素刺激血管内皮细胞提高EVs的生物活性,并在体内外证实了LSS-EVs对巨噬细胞表型的影响。最后,作者通过工程化修饰LSS-EVs以提高在体治疗动脉粥样硬化的能力。该研究为治疗动脉粥样硬化提供新策略。
原文链接:https://doi.org/10.1016/j.biomaterials.2024.122832